Γνωρίζατε για την αντίδραση του Αγίου Δισκοπότηρου στη χημεία;
April 22, 2024
Όταν πρόκειται για φυσικό αέριο, δεν πρέπει να μην είστε εξοικειωμένοι με αυτό, και σήμερα δεν μπορεί να μαγειρέψει το νοικοκυριό χωρίς αυτό. Το κύριο συστατικό του φυσικού αερίου είναι το μεθάνιο, το οποίο είναι μία από τις απλούστερες ενώσεις υδρογονανθράκων. Η επιτάχυνση της ανάπτυξης και της χρήσης του μεθανίου είναι το κλειδί για την πραγματοποίηση της πράσινης και βιώσιμης ανάπτυξης της ενέργειας και της χημικής βιομηχανίας. Εκτός από την άμεση χρήση του ως καύσιμο, το μεθάνιο μπορεί επίσης να χρησιμοποιηθεί ως πόρος C1, δηλαδή ένα μόριο που περιέχει ένα άτομο άνθρακα και μπορεί να συνεχίσει να μετατρέπεται για να παρασκευάσει χημικά προστιθέμενα υψηλής αξίας, όπως η μεθανόλη, η μόρδια οξύ και ούτω καθεξής. Το μεθάνιο μπορεί να καεί σε οξυγόνο για να σχηματίσει νερό και διοξείδιο του άνθρακα. Χωρίς καύση, είναι δυνατόν να ενεργοποιηθούν και να μετατραπούν οι δεσμοί υδρογονανθράκων των μορίων μεθανίου υπό ήπιες συνθήκες; Η απάντηση είναι ναι! Αυτή είναι η αντίδραση "ιερού γκριλ" στον τομέα της κατάλυσης. Οι αντιδράσεις που σχετίζονται με το "Άγιο Δισκοπότηρο" είναι συχνά εξαιρετικά προκλητικές, καθώς μπορεί να χρειαστεί να πραγματοποιηθούν υπό πολύ σκληρές συνθήκες ή μπορεί να χρειαστεί να ξεπεράσουν τις εγγενείς δυσκολίες μιας χημικής αντίδρασης, όπως η ενεργοποίηση των εξαιρετικά σταθερών ενώσεων, χαμηλής αποδόσεις και χαμηλή εκλεκτικότητα. Αυτές οι προκλήσεις καθιστούν δύσκολη την πραγματοποίηση αυτών των αντιδράσεων, αλλά εάν μπορούν να επιτευχθούν με επιτυχία, θα οδηγήσουν σε σημαντικές ανακαλύψεις στην επιστημονική έρευνα και τις βιομηχανικές εφαρμογές.

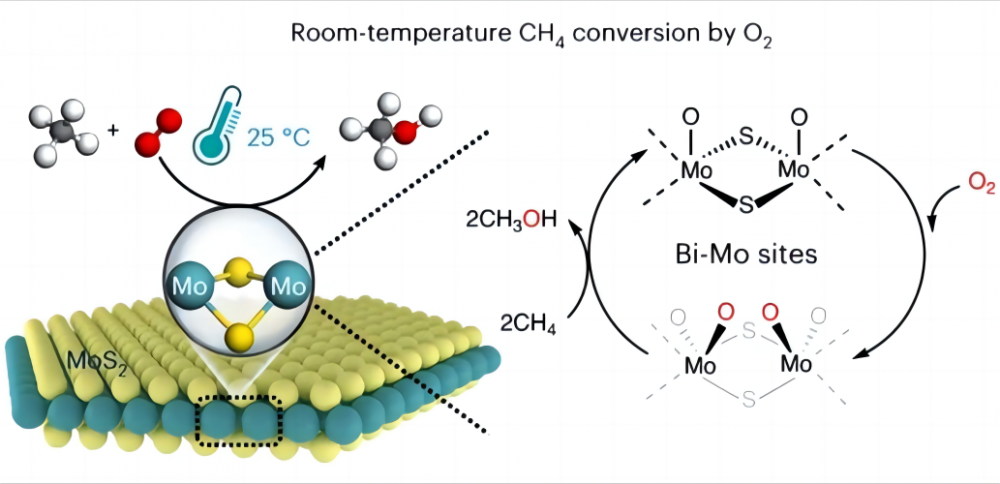
1.Challenges στη μετατροπή του μεθανίου σε χαμηλές θερμοκρασίες Είναι πολύ δύσκολο να μετατρέψετε το μεθάνιο απευθείας σε άλλες χρήσιμες χημικές ουσίες με φθηνό οξυγόνο σε χαμηλές θερμοκρασίες ή ακόμα και θερμοκρασία δωματίου, γιατί είναι αυτό; Ας δούμε τη φύση του μεθανίου και του οξυγόνου. Η χημική δομή του μεθανίου περιέχει τέσσερις πανομοιότυπους δεσμούς άνθρακα-υδρογόνου (CH) που σχηματίζουν μια εξαιρετικά συμμετρική ορθοτετραεδρική διαμόρφωση και κάθε δεσμός CH3-H μεθανίου έχει ενέργεια δεσμού μέχρι 435 kJ/mol. Μπορούμε να σκεφτούμε τον δεσμό CH του μεθανίου ως μια ιδιαίτερα ισχυρή άνοιξη. Αυτή η άνοιξη είναι πολύ τεντωμένη και απαιτεί μεγάλη δύναμη για να τεντώσει. Στη χημεία, αυτή η "δύναμη" είναι η ενέργεια που απαιτείται για να σπάσει ο δεσμός CH. Αυτή η υψηλή ενέργεια συγκόλλησης καθιστά τους δεσμούς CH του μεθανίου θερμοδυναμικά σταθερή και πολύ δύσκολο να σπάσει ή να αντιδράσει με υπό κανονικές συνθήκες. Από την άλλη πλευρά, σε χημικές αντιδράσεις, οι αντιδραστικές ομάδες παράγονται συνήθως υπό πολική αλληλεπίδραση (η πολική αλληλεπίδραση είναι το φαινόμενο που ένα μόριο έχει ένα άκρο θετικά φορτισμένο και το άλλο αρνητικά φορτισμένο), ενώ η συμμετρική δομή και η μη πολική φύση του μεθανίου μορίου αποτρέπουν Από τη δημιουργία μιας τέτοιας πολικότητας (σύμφωνα με τη μοριακή διαμόρφωση, ένα μόριο με επίπεδο συμμετρίας δεν έχει πολικότητα) και δεν μπορεί να παρέχει αντιδραστικές ομάδες. Ως εκ τούτου, η ενεργοποίηση και η μετατροπή του μεθανίου είναι πολύ προκλητική και συνήθως απαιτεί σκληρές συνθήκες όπως υψηλές θερμοκρασίες (600-1100 ° C) ή ορισμένοι "ακραίοφιλοι" όπως υπερ-ισχυρά οξέα και ελεύθερες ρίζες για να βοηθήσουν στην ενεργοποίηση του μεθανίου. Επομένως, η κύρια δυσκολία στην πραγματοποίηση της ενεργοποίησης χαμηλής θερμοκρασίας του μεθανίου και του οξυγόνου έγκειται στο πώς να ενεργοποιηθεί ο δεσμός CH του μεθανίου, δηλαδή πώς να τεντώσει την "άνοιξη" στον δεσμό CH. 2. Το θαύμα του καταλύτη Οι επιστήμονες ήρθαν με μια καλή λύση σε αυτό το πρόβλημα και επέλεξαν να χρησιμοποιήσουν έναν καταλύτη για να βοηθήσουν στην ενεργοποίηση του μεθανίου σε χαμηλές θερμοκρασίες (ένας καταλύτης είναι μια χημική ουσία που δεν αλλάζει πριν ή μετά από μια αντίδραση, αλλά επιταχύνει την αντίδραση μεταβάλλοντας την ελάχιστη ποσότητα της ενέργειας που πρέπει να εγχυθεί για την αντίδραση να γίνει). Το 2023, το περιοδικό Nature Catalysis ανέφερε τη διαδικασία επίτευξης της άμεσης μετατροπής του μεθανίου με οξυγονήματα με C1 (μεθανόλη (CH3OH), μυρμηκικό οξύ (HCOOH) και μεθυλενογλυκόλη (HoCh2OH)) χρησιμοποιώντας ένα συγκεκριμένο δομίδιο μολυβδένιου (Mos2) καταλύτης στους 25 ° C. Η μετατροπή μεθανίου 4,2% και σχεδόν 100% οξυγονωμάτων C1 επιτεύχθηκε με τη μετατροπή του μεθανίου και του οξυγόνου σε πολύτιμα C1 οξυγόνου υπό συνθήκες περιβάλλοντος. Αυτό το MOS2 είναι ο μόνος καταλύτης που αναφέρθηκε μέχρι στιγμής που μπορεί να συνειδητοποιήσει τη μετατροπή θερμοκρασίας δωματίου του μεθανίου και του οξυγόνου. Όλα αυτά οφείλονται στη μοναδική γεωμετρία και την ηλεκτρονική δομή της θέσης MO στην άκρη του MOS2. Αυτή η θέση MO έχει υψηλή δραστικότητα ενεργοποίησης προς οξυγόνο σε ένα υδατικό περιβάλλον, σχηματίζοντας το μαγικό o = mo = o* είδος. Αυτό το είδος καθιστά τον δεσμό άνθρακα-υδρογόνου ευκολότερο να σπάσει και να μειώσει την ενέργεια ενεργοποίησης του δεσμού CH του μεθανίου, αυξάνοντας έτσι σημαντικά την αντιδραστικότητα του μεθανίου, και έτσι συνειδητοποιώντας την ενεργοποίηση χαμηλής θερμοκρασίας του μεθανίου και του οξυγόνου. Αυτή η ανακάλυψη θα φέρει περισσότερες δυνατότητες για τη μελλοντική χρήση της ενέργειας και την προστασία του περιβάλλοντος, καθώς και θα μας δώσει μια βαθύτερη κατανόηση του εκπληκτικού ρόλου των καταλυτών και των βοηθητικών.
3. Σημαντική στρατηγική σημασία της ενεργοποίησης χαμηλής θερμοκρασίας του μεθανίου Η συνειδητοποίηση της άμεσης καταλυτικής μετατροπής του μεθανίου και του οξυγόνου σε θερμοκρασία δωματίου και η μετατροπή του μεθανίου σε φυσικό αέριο σε άλλες χρήσιμες χημικές ουσίες, μπορεί να βελτιώσει σημαντικά το ποσοστό χρήσης του φυσικού αερίου, να μειώσει τα απόβλητα και να προστατεύει καλύτερα το περιβάλλον και να συνειδητοποιήσει την βιώσιμη ανάπτυξη ενέργειας . Δεύτερον, ως αέριο θερμοκηπίου, το μεθάνιο είναι δεύτερο μόνο στο διοξείδιο του άνθρακα στη συμβολή του στην υπερθέρμανση του πλανήτη. Εάν το μεθάνιο μπορεί να μετατραπεί σε άλλες ουσίες, μπορεί να μας βοηθήσει να μειώσουμε την εκπομπή ατμοσφαιρικών ρύπων (π.χ. οξείδια του άνθρακα, οξείδια αζώτου, οξείδια θείου, υδρογονάνθρακες και ενώσεις αιθέρα) και να διευκολύνουν την πίεση της υπερθέρμανσης του πλανήτη.




